Chemia organiczna/Związki wielofunkcyjne: Różnice pomiędzy wersjami
m (Magdaz przeniósł stronę CHEM:Chemia organiczna/Związki wielofunkcyjne do Chemia organiczna/Związki wielofunkcyjne) |
|||
| (Nie pokazano 1 pośredniej wersji utworzonej przez tego samego użytkownika) | |||
| Linia 113: | Linia 113: | ||
==Cukry== | ==Cukry== | ||
| − | Ważną i obficie reprezentowaną w przyrodzie klasą związków wielofunkcyjnych są cukry zwane też sacharydami albo węglowodanami. Pod względem budowy cukry można określić jako polihydroksyaldehydy i polihydroksyketony. Jednak analizując strukturę cukrów trudno jest znaleźć grupę karbonylową, bowiem w rzeczywistości cukry tworzą [[ | + | Ważną i obficie reprezentowaną w przyrodzie klasą związków wielofunkcyjnych są cukry zwane też sacharydami albo węglowodanami. Pod względem budowy cukry można określić jako polihydroksyaldehydy i polihydroksyketony. Jednak analizując strukturę cukrów trudno jest znaleźć grupę karbonylową, bowiem w rzeczywistości cukry tworzą [[Chemia_organiczna/Związki_heteroaromatyczne|pierścienie heterocykliczne]] wskutek spontanicznej wewnątrzcząsteczkowej reakcji grupy karbonylowej z określoną grupą hydroksylową z [[Chemia_organiczna/Alkohole|utworzeniem cyklicznego hemiacetalu]]. |
Ogólnie cukry dzielimy na cukry proste (zwane monosacharydami) oraz cukry złożone (oligo- i polisacharydy). Monosacharydy, które są polihydroksyketonami nazywamy ogólnie ketozami, a polihdroksyaldehydy — aldozami. Monosacharydy mogą składać się z łańcucha węglowego trój-, cztero-, pięcio-, sześcio- i więcej członowego i ogólnie nazywają się wtedy odpowiednio: triozami, tetrozami, pentozami, heksozami itd. | Ogólnie cukry dzielimy na cukry proste (zwane monosacharydami) oraz cukry złożone (oligo- i polisacharydy). Monosacharydy, które są polihydroksyketonami nazywamy ogólnie ketozami, a polihdroksyaldehydy — aldozami. Monosacharydy mogą składać się z łańcucha węglowego trój-, cztero-, pięcio-, sześcio- i więcej członowego i ogólnie nazywają się wtedy odpowiednio: triozami, tetrozami, pentozami, heksozami itd. | ||
Aktualna wersja na dzień 18:50, 4 cze 2015
Wiele związków organicznych zawiera w cząsteczce więcej niż jedną grupę funkcyjną. Do takich związków możemy zaliczyć na przykład alkenole (podwójne wiązanie i grupa hydroksylowa), aldole (grupa aldehydowa i hydroksylowa), kwasy halogenokarboksylowe (atom halogenu i grupa karboksylowa) itd. Obecność drugiej grupy funkcyjnej powoduje pojawienie się dwu pytań, jednego formalnego – jak nazywać takie związki, i drugiego merytorycznego – jakie są właściwości takich związków. Odpowiedzi na te pytania na poziomie ogólnym nie są jednoznaczne, gdyż zależą od szczegółów budowy danego związku.
W nazewnictwie, tradycyjnie niektóre grupy funkcyjne uważa się za ważniejsze od innych. Przybliżoną kolejność pierwszeństwa grup funkcyjnych podaje zestawienie poniżej. Słowo „przybliżoną” ma o tyle rację bytu, że nieraz istnieją odstępstwa od tej hierarchii podstawników.
Grupy funkcyjne wraz z ich przedrostkami i przyrostkami, uszeregowane w przybliżonej kolejności pierwszeństwa
| Grupa | Przedrostek | Przyrostek |
|---|---|---|
| NH3, SR2, itp. | –oniowy (chlorek itp..) | |
| COOH | karboksy- | kwas –owy, kwas –karboksylowy |
| SO3H | sulfo- | kwas –sulfonowy |
| COCl | chloroformylo- | chlorek –oilu |
| CONH2 | karbamoilo- | –amid |
| CHO | formylo- | –al, aldehyd –owy |
| CN | cyjano- | –nitryl |
| C=O (RCO, np.CH3CO) | keto-, okso- | –on |
| (acylo, np. acetylo-) | ||
| OH | hydroksy- | –ol |
| NH2 | amino- | –amina |
| –O– (OR, np.OCH3) | alkoksy- (np.metoksy) | |
| –N=N – | azo- | |
| NO2 | nitro- | |
| NO | nitrozo- | |
| Cl, Br | chloro-, bromo- |
Dane z tej tablicy należy odczytywać w ten sposób, że nazwa grupy funkcyjnej najważniejszej spośród grup obecnych w budowie związku znajduje się w przyrostku nazwy, a obecność innych grup funkcyjnych zaznacza się w przedrostku. Na przykład grupa hydroksylowa (–OH) znajduje się w tablicy wyżej od halogenów czy grupy aminowej, dlatego związek o wzorze ClCH2CH2OH ma nazwę 2-chloroetanol i podobnie H2NCH2CH2OH to 2-aminoeatnol (chociaż w tym ostatnim przypadku można się też spotkać z nazwą zwyczajową etanoloamina). Natomiast grupa karbonylowa i karboksylowa położone są wyżej od grupy hydroksylowej, dlatego takie związki jak HOCH2CH2CHO i HOCH2CH2COOH noszą nazwy odpowiednio: 3-hydroksypropanal i kwas 3-hydroksypropanowy. Jeżeli w związku występują grupy funkcyjne, którym w nazwach nie przyporządkowuje się przyrostków, to nazwę związku wywodzi się od węglowodoru i podstawniki wymienia alfabetycznie, np. 4-chloro-1-nitrobenzen, 1-bromo-2-chloroetan. Obecność wiązań wielokrotnych zaznacza się w przyrostku i wtedy w nazwie związku może pojawić się więcej przyrostków, np. hept-1-en-6-in-4-ol.
W większości przypadków obecność drugiej grupy funkcyjnej zmienia właściwości związku tylko w ograniczonym zakresie i charakter chemiczny związku określony jest obecnością grupy dominującej, np. kwasy dikarboksylowe, kwasy hydroksykarboksylowe, czy nitrokarboksylowe traktuje się ciągle jako kwasy. Karboksylowa grupa funkcyjna jest w nich grupą dominującą, nadającą im określone kwasowe właściwości chemiczne. W niektórych związkach organicznych wprowadzenie jednak dodatkowych grup funkcyjnych zmienia ich właściwości na tyle, że wyodrębnia się je w oddzielne klasy związków. Tak czyni się z aminokwasami i cukrami, które zresztą i tak, niezależnie od budowy strukturalnej, są szeroko badane z powodu ich dużego znaczenia w przyrodzie jako naturalnych, podstawowych składników budowy materii ożywionej.
Aminokwasy
Aminokwasem można nazwać każdy związek, który zawiera w swojej budowie grupę karboksylową i aminową. Jednak w chemii, biochemii i biologii nazwę tę kojarzy się na ogół tylko z wąską grupą dwudziestu kilku związków — składników budulcowych białek. Aminokwasy naturalne są tzw. kwasami [math]\alpha[/math]-aminokarboksylowymi, w których grupa aminowa znajduje się przy atomie węgla sąsiednim do grupy karboksylowej. Wzór ogólny aminokwasów wygląda następująco:

Izomeria optyczna
Wiele związków organicznych, w tym aminokwasy i cukry wspomniane w poprzednim podrozdziale, zawiera tzw. asymetryczny atom węgla. Asymetria wynika z różnego przestrzennego rozmieszczenia czterech różnych podstawników wokół tetraedrycznego (str. 7) atomu węgla. Na przykład aminokwasy (z wyjątkiem najprostszego — kwasu aminooctowego) mogą występować w postaci dwóch odmian różniących się od siebie tak jak obraz i jego odbicie lustrzane, zwanych ogólnie enancjomerami .
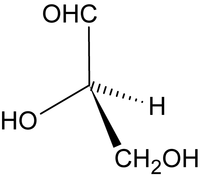
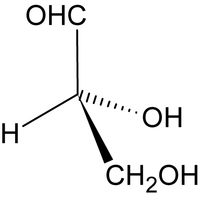
Podstawową metodą rozróżniania enancjomerów jest polarymetria, czyli pomiary skręcenia płaszczyzny światła spolaryzowanego kołowo po przejściu promieni świetlnych przez próbkę związku (najczęściej przez roztwór badanej substancji w rozpuszczalniku). Tradycyjnym, używanym w chemii aminokwasów i cukrów, wzorcem oznaczania konfiguracji w izomerach optycznych jest aldehyd glicerynowy.
|
|
| aldehyd D-(+)-glicerynowy (aldehyd (R)-glicerynowy) | aldehyd L-(-)-glicerynowy aldehyd (S)-glicerynowy |
Aldehyd D-glicerynowy skręca płaszczyznę światła spolaryzowanego w prawo i stąd bierze się przedrostek „D” (od łacińskiego słowa dextrus — prawoskrętny). Drugi enancjomer otrzymuje przedrostek „L” od łacińskiego słowa levo. Ogólnie związki skręcające płaszczyznę światła spolaryzowanego określamy jako czynne optycznie i nazywamy związkami chiralnymi. Asymetryczny atom węgla w cząsteczce albo inny element strukturalny powodujący chiralność związku bywa określany jako centrum stereogeniczne.
Wzory perspektywiczne bardziej rozbudowanych związków stają się mało czytelne. Bardzo często do odzwierciedlania budowy związków chiralnych na papierze (tablicy, itp.) stosuje się wzory rzutowe Fischera (wprowadzone przez niemieckiego chemika Emila Fischera w XIX wieku). Wzór taki tworzy się z zachowaniem określonej konwencji, która polega na ustawieniu łańcucha węglowego cząsteczki związku w linii pionowej z atomem węgla o najwyższym stopniu utlenienia u góry i poszczególnymi bocznymi podstawnikami skierowanymi ku oku patrzącego. Po zrzutowaniu tak ułożonej cząsteczki na płaszczyznę powstaje wzór Fischera. Prosty przykład pokazany jest poniżej na Rys. Figure 3.
Każdy asymetryczny atom węgla, przy którym podstawnik większy od atomu wodoru znajdzie się na wzorze Fischera po prawej stronie ma konfigurację D, i odwrotnie jeśli podstawnik znajdzie się po lewej stronie określamy konfigurację danego atomu węgla jako L, na przykład:
Ta konwencja Fischera oznaczania konfiguracji nosi nazwę systemu DL. Jednak jej zastosowanie do bardziej skomplikowanych chiralnych związków organicznych jest ograniczone. Dlatego opracowano bardziej uniwersalny system oznaczania konfiguracji centrów stereogenicznych. Ten sposób określa się jako regułę Cahna-Ingolda-Preloga lub w skrócie jako system RS. W tym systemie podstawniki przy atomie węgla klasyfikuje się według masy atomowej pierwiastka związanego z atomem węgla. W przypadku takiej samej masy rozpatruje się masy atomowe drugiego z kolei atomu, itd. Podstawnik najlżejszy uzyskuje status odnośnika, a pozostałe trzy podstawniki porządkuje się od najcięższego (najważniejszego) do coraz lżejszych. Jeśli w przestrzeni, patrząc od strony przeciwnej niż podstawnik odnośnikowy kolejność wypadnie zgodnie z ruchem wskazówek zegara, to konfigurację oznaczamy jako R (od łacińskiego rectus), a jeśli niezgodnie z ruchem wskazówek zegara, to konfiguracja jest S (od łac. sinister). Na przykład:
Następny przykład podany na Rys. Figure 6. podaje sposób ustalania ważności podstawników w przypadku, gdy atom węgla związany jest z kilkoma takim samymi atomami. W przykładzie tym asymetryczny atom węgla związany jest z atomem wodoru (podstawnik najlżejszy — odnośnik) i z trzema atomami węgla. Podstawnik CH2OH jest najważniejszy, ponieważ w nim atom węgla związany jest z atomem tlenu (M. at. 16), a w grupie CH2CH3 atom węgla jest związany z następnym atomem węgla (M. at. 12). W grupie CH3 atom węgla związany jest tylko z atomami wodoru (M. at. 1).
Cukry
Ważną i obficie reprezentowaną w przyrodzie klasą związków wielofunkcyjnych są cukry zwane też sacharydami albo węglowodanami. Pod względem budowy cukry można określić jako polihydroksyaldehydy i polihydroksyketony. Jednak analizując strukturę cukrów trudno jest znaleźć grupę karbonylową, bowiem w rzeczywistości cukry tworzą pierścienie heterocykliczne wskutek spontanicznej wewnątrzcząsteczkowej reakcji grupy karbonylowej z określoną grupą hydroksylową z utworzeniem cyklicznego hemiacetalu.
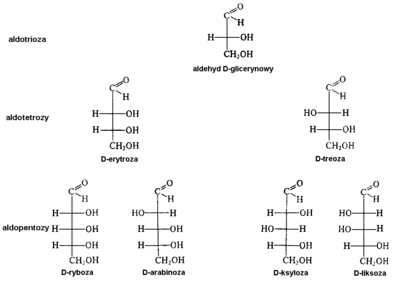
Ogólnie cukry dzielimy na cukry proste (zwane monosacharydami) oraz cukry złożone (oligo- i polisacharydy). Monosacharydy, które są polihydroksyketonami nazywamy ogólnie ketozami, a polihdroksyaldehydy — aldozami. Monosacharydy mogą składać się z łańcucha węglowego trój-, cztero-, pięcio-, sześcio- i więcej członowego i ogólnie nazywają się wtedy odpowiednio: triozami, tetrozami, pentozami, heksozami itd.
Pojęcie „szereg D” oznacza, że w każdej z przedstawionych cząsteczek grupa OH przy przedostatnim (ostatnim asymetrycznym) atomie węgla znajduje się po prawej stronie wzoru Fischera, a więc ma konfigurację D, taką samą jak we wzorcu, którym jest aldehyd D-glicerynowy. Należy rozumieć, że istnieje również analogiczny szereg konfiguracyjny monosacharydów szeregu L.
Podobnie Rys. Figure 8. pokazuje monosacharydy o łańcuchu sześciowęglowym czyli heksozy. Należy również wiedzieć, że istnieje osiem enancjomerów tych związków szeregu L. Następny Rys. Figure 9. zawiera z kolei wzory Fischera form łańcuchowych ketoz.
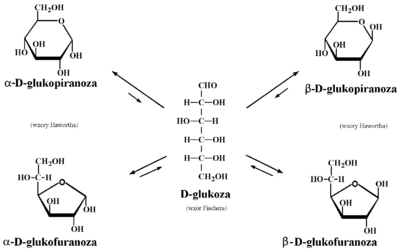
Monosacharydy jednak nie występują w formach łańcuchowych (w roztworach zawartość formy łańcuchowej na ogół nie przekracza jednego procenta), ale w formach cyklicznych, jak to już było zaznaczone na początku tego podrozdziału. Tworzenie się form cyklicznych pokazane jest na przykładzie D-glukozy na Rys. Figure 10.
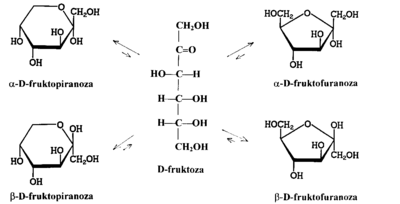
Formy cykliczne pięcioczłonowe uzyskują końcówkę „furanoza”, a sześcioczłonowe —„piranoza” (porównaj nazwy „furan” i „piran”). W formach cyklicznych monosacharydów przy pierwszym atomie węgla (węgiel grupy aldehydowej formie łańcuchowej w aldozach) pojawia się nowe centrum stereogeniczne. Taki atom węgla nazywa się w cukrach anomerycznym, a utworzone dwa anomery oznacza się literami greckimi „[math]\alpha[/math]” i „[math]\beta[/math]” (nowe użycie tych liter, zupełnie inne niż w numeracji atomów węgla w naftalenie czy w aldehydach i kwasach). Anomer [math]\alpha[/math] to taki, w którym konfiguracja anomerycznego atomu węgla jest zgodna z szeregiem konfiguracyjnym danego cukru, czyli w przypadku monosacharydów szeregu D jest ona D. Anomer [math]\beta[/math] ma konfigurację L na atomie węgla anomerycznego.
W przypadku ketoz anomerycznym atomem węgla jest drugi z kolei w łańcuchowej formie monosacharydu.
Cukry złożone tworzą się, gdy jedna cząsteczka monosacharydu (będąca wspomnianym przed chwilą hemiacetalem) reaguje z grupą hydroksylową drugiego monosacharydu z utworzeniem acetalu. Przykładami cukrów złożonych są laktoza (cukier mleczny) i sacharoza (cukier buraczany lub trzcinowy) pokazane na Rys. Figure 12.
Są to przykłady disacharydów — cząsteczek zbudowanych z dwu monosacharydów. Związki zbudowane z wielu jednostek monosacharydowych to polisacharydy. Do najbardziej znanych polisacharydów zalicza się skrobię, celulozę i glikogen.
Wiązanie acetalowe łączące dwa monosacharydy nazywa się wiązaniem glikozydowym. Polisacharydy zawierają wiele wiązań glikozydowych i tworzą długie łańcuchy połączonych ze sobą, nieraz z rozgałęzieniami, jednostek monosacharydowych.
Ze względu na dużą różnorodność konfiguracyjną monosacharydów, możliwość tworzenia różnych wiązań glikozydowych oraz możliwą obecność jeszcze innych grup funkcyjnych w jednostkach monosacharydowych (grupa aminowa zamiast grupy hydroksylowej, grupa karboksylowa zamiast końcowej grupy CH2OH, tworzenie estrów kwasu siarkowego i fosforowego z grupami hydroksylowymi) istnieje ogromna liczba funkcjonalnych biologicznie węglowodanów i ich połączeń z innymi związkami. Niektóre z nich, a szczególnie kwasy nukleinowe zostaną omówione szerzej na wykładach z chemii bioorganicznej, biochemii i biologii molekularnej.