Chemia organiczna/Alkohole
Spis treści
Budowa i nomenklatura alkoholi.
Alkoholami nazywamy związki organiczne o wzorze ogólnym ROH, czyli substancje w których jeden lub więcej atomów wodoru w węglowodorze zostało zastąpione grupą —OH (wodorotlenową, hydroksylową). Wzór alkoholi można również wyprowadzić od cząsteczki wody. W tym ujęciu jeden z atomów wodoru w wodzie jest zastąpiony resztą węglowodorową. Wiązanie pojedyncze węgiel-tlen w alkoholach jest spolaryzowane, ponieważ tlen jest bardziej elektroujemny niż węgiel.
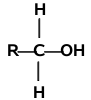
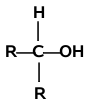
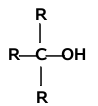
Analogicznie jak dla fluorowcopochodnych istnieją alkohole o różnej rzędowości:
|
|
|
| Alkohol pierwszorzędowy | Alkohol drugorzędowy | Alkohol trzeciorzędowy |
Poniżej, Rys. Figure 1. podaje właściwości fizyczne wybranych alkoholi niskocząsteczkowych.
| Nazwa (rzędowość) | Wzór | T. wrz., [°C] | Gęstość, [g/cm3] | Rozp. [g/100 g wody] |
|---|---|---|---|---|
| metanol (I) | CH3OH | 64,5 | 0,793 | ∞ |
| etanol (I) | CH3CH2OH | 78,3 | 0,789 | ∞ |
| propan-1-ol (I) | CH3CH2CH2OH | 97 | 0,804 | ∞ |
| propan-2-ol (II) | (CH3)2CHOH | 82,5 | 0,789 | ∞ |
| butan-1-ol (I) | CH3(CH2)2CH2OH | 118 | 0,810 | 7,9 |
| butan-2-ol (II) | CH3CHOHCH2CH3 | 99,5 | 0,806 | 12,5 |
| 2-metylopropan-1-ol (I) | (CH3)2CHCH2OH | 108 | 0,802 | 10,0 |
| 2-metylopropan-2-ol (III) | (CH3)3COH | 83 | 0,789 | ∞ |
| cyklopentanol (II) | C5H9OH | 140 | 0,949 | ∞ |
| cykloheksanol (II) | C6H11OH | 161,5 | 0,962 | 3,6 |
Analizując dane zawarte w tej tabeli zauważamy:
- Nazwy systematyczne alkoholi tworzymy dodając do nazwy macierzystego węglowodoru (tzn. takiego, w którym atom wodoru zastąpiony jest grupą OH) końcówkę -ol. Pozostałe reguły nazewnictwa systematycznego są takie same jak dla związków omówionych dotychczas (węglowodory, fluorowcopochodne). A więc systematyczna nazwa ogólna alkoholi to alkanole. W hierarchii ważności podstawników grupa hydroksylowa ma pierwszeństwo przed dotychczas poznanymi grupami funkcyjnymi. Na przykład gdy w łańcuchu węglowym występuje podwójne wiązanie, to atomy węgla numeruje się tak, aby grupa hydroksylowa znajdowała się przy atomie o niższym lokancie. Obecność kilku grup hydroksylowych w jednej cząsteczce zaznacza się końcówkami -diol, -triol itd. Dalsze przykłady budowy i nazw alkoholi podane są na Rys. Figure 2. Oprócz nazw systematycznych równolegle egzystują nazwy opisowe np. alkohol etylowy, alkohol benzylowy, alkohol allilowy, alkohol tert-butylowy. W niektórych nazwach alkoholi trzecio- i drugorzędowych zachował się rdzeń "karbinol" oznaczający pochodną metanolu, np. trifenylokarbinol.
- Alkohole są lżejsze od wody, a wszystkie homologi o małych cząsteczkach rozpuszczają się dobrze w wodzie.
- Atom tlenu w alkoholach ma dwie wolne pary elektronowe. Elektrony te mogą brać udział w tworzeniu wiązań wodorowych, oddziałując z protonami z innych cząsteczek zawierających spolaryzowane wiązanie z udziałem atomu wodoru (np. O—H, N—H). Zdolność tworzenia wiązań wodorowych przez alkohole powoduje, że wykazują one stosunkowo wysoką temperaturę wrzenia w porównaniu z innymi związkami organicznymi o zbliżonej masie cząsteczkowej (np. propan o m.cz. 44 wrze w temp. –42°C, podczas gdy etanol o zbliżonej m.cz. = 46 ma temperaturę wrzenia 78,3 °C). Również tworzenie wiązań wodorowych międzycząsteczkowych leży u podstaw dużej rozpuszczalności alkoholi w wodzie.
Właściwości chemiczne alkoholi.
Alkohole należą do znanych od dawna związków chemicznych i wykorzystywane są często jako substraty do otrzymywania innych, bardziej skomplikowanych związków. Znajdują też zastosowanie jako rozpuszczalniki w laboratorium, w artykułach gospodarstwa domowego i w przemyśle. Reaktywność alkoholi obejmuje możliwość rozerwania wiązań O—H, C—O oraz C—H. Przykłady reakcji alkoholi podaje poniższy Rys. Figure 3.
Reakcje 1 i 2 na powyższym schemacie ilustrują kwasowe właściwości atomu wodoru w grupie hydroksylowej (proton jako akceptor elektronu z atomu metalu). A więc w tych przypadkach reakcje obejmują rozerwanie wiązania O—H w alkoholu.
Reakcje 3 i 4 to przykłady otrzymywania estrów. W pkt. 3 jest to reakcja alkoholu z kwasem azotowym (kwasem nieorganicznym), a w pkt. 4 analogiczna reakcja z kwasem karboksylowym. Takie reakcje estryfikacji następują na ogół z rozerwaniem wiązania O—H w alkoholu. A więc w cząsteczkach estrów atomy tlenu związane z resztą R i R2, odpowiednio w pkt. 3 i 4, pochodzą z alkoholu, a atomy tlenu pochodzące z kwasów znajdują się w cząsteczkach wody. Dokładniej z mechanizmem reakcji estryfikacji zapoznamy się w rozdziale o kwasach karboksylowych.
Pkt. 5 podaje reakcję odwrotną do pokazanej w poprzednim rozdziale (Rys 4., synteza alkoholi, X = Cl, Br, I). Należy tu dodać, że w chemii organicznej większość reakcji jest odwracalna. W zależności od warunków eksperymentalnych równowaga może być przesuwana w jedną lub w drugą stronę. Reakcja pokazana w pkt.5 następuje według mechanizmu substytucji nukleofilowej, a rozerwaniu ulega wiązanie C—O.
Reakcje w pkt. 6 i 7 to następne przykłady konkurencyjności reakcji eliminacji i substytucji nukleofilowej. Pod działaniem stężonego kwasu siarkowego w podwyższonej temperaturze głównym produktem przemiany alkoholu jest alken czyli produkt eliminacji. Rozerwaniu w tym przypadku ulegają zarówno wiązanie C—O jak i C—H przy sąsiednim atomie węgla. Jako dygresję, należy wspomnieć, że reakcja odwrotna do podanej w pkt. 6 (i częściej wykorzystywana w przemyśle chemicznym) była już pokazana wcześniej na Rys. 4. Reakcja w pkt. 7 to otrzymywanie eterów. W warunkach podobnych do podanych w pkt. 6, pod działaniem stężonego kwasu siarkowego, ale w niższej temperaturze alkohol ulega reakcji substytucji nukleofilowej (czynnikiem nukleofilowym jest druga cząsteczka alkoholu).
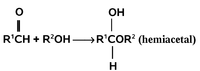
Następna reakcja podana w pkt. 8 pokazuje aktywność alkoholi względem grupy karbonylowej (C=O, patrz. rozdziały o aldehydach i związkach wielofunkcyjnych). Jest to reakcja tworzenia hemiacetali (półacetali) z aldehydów i niektórych ketonów. Reakcja następuje z rozerwaniem wiązania O—H. Jej mechanizm będzie zreferowany później.
Pkt. 9 pokazuje możliwość utleniania alkoholu pierwszorzędowego do aldehydu, lub dalej do kwasu karboksylowego. Mechanizmy reakcji utleniania są raczej skomplikowane, zależne od zastosowanego czynnika utleniającego. W przypadku tworzenia aldehydu z alkoholu rozerwaniu ulega wiązanie O—H i C—H przy węglu związanym z tlenem.
Pkt. 10 pokazuje analogiczną reakcję utleniania, ale z alkoholem drugorzędowym. Produktem w tym przypadku jest odpowiedni keton. Nie ma możliwości dalszego utleniania do kwasu karboksylowego (o ile nie stosuje się ostrych warunków utleniania). Alkohole trzeciorzędowe takiej reakcji utleniania nie ulegają.
Otrzymywanie alkoholi.
Ogólną przemysłową metodą otrzymywania alkoholi jest reakcja przyłączania wody do alkenów. Metanol uzyskuje się w dużych ilościach z surowców nieorganicznych według następującego schematu:
- CO + 2H2 → CH3OH
Wiele jednak alkoholi można otrzymywać z produktów naturalnych. Najdawniej opanowaną przez człowieka technologią produkcji alkoholu etylowego jest fermentacja skrobii lub innych bogatych w cukry surowców (miód, winogrona i inne owoce). W mniejszych ilościach podczas procesu fermentacji alkoholowej tworzą się też alkohole pierwszorzędowe o dłuższych łańcuchach węglowych, które można wyodrębnić z tzw. fuzli czyli pozostałości po oddestylowaniu frakcji zawierającej etanol. Można też wspomnieć o otrzymywaniu glicerolu z surowców tłuszczowych przy okazji produkcji mydła, czy metanolu jako produktu tzw. suchej destylacji drewna.
Warto wiedzieć, że alkohole wykazują właściwości trujące dla organizmów żywych. Stosunkowo najmniej trujący jest alkohol etylowy, który od dawna jest używany jako składnik napojów (piwo, wino, wódki).
Etanol uzyskiwany podczas oczyszczania na drodze destylacji tworzy z wodą mieszaninę azeotropową, która zawiera 4% wody (wagowo). Taki produkt nosi komercyjną nazwę spirytusu. Do celów chemicznych używany jest również etanol odwodniony (specjalnymi metodami), zawierający tylko śladowe ilości wody, np. 0,02 %.