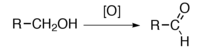PCzEB/Przeglad wlasciwosci najwazniejszych grup związkow organicznych II
Spis treści
ALDEHYDY I KETONY — zarys właściwości
Aldehydy i ketony łącznie stanowią klasę związków określanych jako związki karbonylowe.
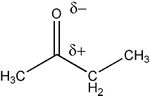
Wspólnym elementem ich budowy jest grupa karbonylowa "-C=O", która w znacznym stopniu określa właściwości chemiczne aldehydów i ketonów.
Aldehydy

|

|

|
| metanal (formaldehyd) | etanal (acetaldehyd) | propanal |
Ketony

|

|

|
| propanon (aceton) | butanon | pentan-3-on |
Wiązanie jest spolaryzowane w stronę bardziej elektroujemnego atomu tlenu i w ten sposób na atomie węgla występuje cząstkowy ładunek dodatni. Jest to zatem centrum elektrofilowe w reakcjach przyłączenia.
Niskocząsteczkowe aldehydy i ketony dobrze rozpuszczają się w wodzie dzięki możliwości tworzenia wiązań wodorowych z cząsteczkami wody (formaldehyd, acetaldehyd, aceton).
Otrzymywanie aldehydów i ketonów
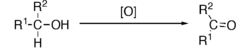
Podstawową metodą otrzymywania aldehydów i ketonów jest utlenianie alkoholi.
W wyniku utleniania alkoholi 1o (pierwszorzędowych) otrzymujemy aldehydy:
Utlenianie alkoholi 2o prowadzi do ketonów:
Najważniejszą reakcją grupy karbonylowej jest reakcja addycji nukleofilowej (jest to proces polegający na przyłączeniu reagenta nukleofilowego do grupy karbonylowej substratu. W reakcji tej rozerwaniu ulega wiązanie [math]\pi[/math] i utworzone zostają dwa nowe wiązania pojedyncze).
Cyjanohydryny
Addycja cyjanowodoru prowadzi do otrzymania cyjanohydryn:
Wiązanie iminowe
Reakcja addycji związków zawierających grupę NH2 (amin) prowadzi do otrzymania produktu z wiązaniem podwójnym C=N (jest to wiązanie iminowe):
KWASY KARBOKSYLOWE
Otrzymywanie: m.in w wyniku utlenienia aldehydów. Jeśli reakcja prowadzona jest w środowisku kwaśnym, to otrzymujemy kwas karboksylowy, w obecności alkaliów produktem jest oczywiście odpowiednia sól kwasu karboksylowego.
Kwasy karboksylowe ze względu na ich moc uznajemy za kwasy słabe w porównaniu z mocą kwasów nieorganicznych. Wyjątek stanowi kwas mrówkowy HCOOH (występujący m.in. we włoskach parzących pokrzyw oraz w jadzie mrówek), którego 1 molowy (1M) roztwór, ma pH ok. 0,5.
Reakcje kwasów karboksylowych:
- tworzenie soli
[math]\mathrm{CH}_3\mathrm{COOH}+\mathrm{CaCO}_3\rightarrow \left(\mathrm{CH}_3\mathrm{COO}\right)_2\mathrm{Ca}+\mathrm{H}_2\mathrm{O}+\mathrm{CO}_2[/math] [math]\mathrm{RCOOH}+\mathrm{NH}_3\rightarrow \mathrm{RCOO}^-\mathrm{NH}_4^+[/math] - tworzenie amidów (konieczne jest silne ogrzanie)
[math]\mathrm{RCOO}^-\mathrm{NH}_4^+\rightarrow \mathrm{RCOONH}_2+\mathrm{H}_2\mathrm{O}[/math]
ESTRY KWASÓW KARBOKSYLOWYCH
Estrami nazywamy pochodne kwasów, w których atom wodoru grupy hydroksylowej zastąpiony został resztą organiczną – grupą alkilową lub arylową.
Można je uważać za produkty reakcji kwasów z alkoholami (reakcja estryfikacji), podczas której wydziela się cząsteczka wody.
Reakcja estryfikacji jest reakcją odwracalną, wobec czego do osiągnięcia wysokiej wydajności potrzebne jest stosowanie nadmiaru jednego z reagentów, oczywiście tego tańszego. Najczęściej są to niższe alkohole, tj. metylowy, etylowy czy propanole. Nadmiar alkoholu pełni równocześnie rolę rozpuszczalnika. Równowagę reakcji estryfikacji można też przesunąć na prawo usuwając jeden z produktów, najczęściej wodę (można ją oddestylować bądź usunąć na drodze chemicznej poprzez dodanie środka odwadniającego).
Estry należą do jednych z najbardziej rozpowszechnionych związków
naturalnych. Do estrów należą przede wszystkim tłuszcze, woski i wiele
innych lipidów.
Tłuszczami
właściwymi nazywamy estry kwasów tłuszczowych z glicerolem (tzw. triacyloglicerole).
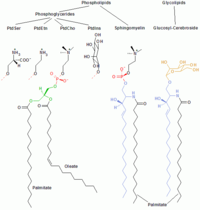
Tłuszcze zwierzęce zawierają znaczne ilości całkowicie nasyconych kwasów tłuszczowych, dlatego zestalają się w niższych temperaturach. Tłuszcze roślinne (oleje) posiadają na ogół znaczniejszy udział kwasów nienasyconych (np. oleinowego). Fosfolipidy do przykłady lipidów złożonych – tworzą podwójna warstwę fosfolipidową błon komórkowych.
|
|

|
|
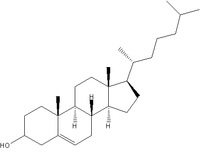
| Cholesterol | Trójgliceryd | Wolny kwas tłuszczowy | Tłuszcze tworzące błony, w tym fosfolipidy |
Przykłady estrów
Estry są ważnymi składnikami olejków eterycznych kwiatów, owoców i ziół.

|

|

|
| mrówczan etylu | octan butylu | octan heksylu |
Mrówczan etylu wchodzi w skład aromatu jabłek, brzoskwiń i rumu; octan butylu – jabłek, gruszek, moreli i tymianku; octan heksylu znaleziono w aromacie jabłek, moreli, bananów, whisky i wina;

|

|
| octan benzylu | propionian etylu |
octan benzylu ma zapach jaśminu; propionian etylu — zawarty jest w aromacie jabłek, pomidorów, owoców guajawy. Aromaty naturalne są złożonymi, wieloskładnikowymi mieszaninami, a estry odgrywają w nich ważną rolę.
Zastosowanie estrów
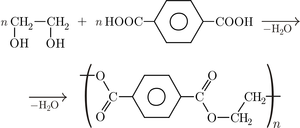
|
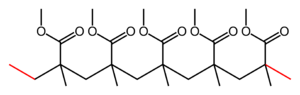
|

|
| Otrzymywanie poliestru | Pleksi | Otrzymywanie biopaliw |
- Poliester (terylen, dakron, elana) otrzymany w wyniku reakcji polikondendensacji glikolu etylenowego i kwasu ftalowego znalazł zastosowanie m.in. w przemyśle włókienniczym do produkcji tkaniny polartec.
- Pleksi (poli-metakrylan metylu, bezpieczne szkło) — analog polietylenu, zawierający grupy estrowe.
- Biodiesel (estry metylowe kwasów tłuszczowych) — to biopaliwo (przetworzony chemicznie olej roślinny, np. rzepakowy) do silników wysokoprężnych (Diesla).
AMINY
Aminy to pochodne amoniaku. Atom azotu posiada hybrydyzację sp3, a obecność wolnej pary elektronowej na atomie azotu decyduje o tym, że aminy są zasadami Lewisa. Są także akceptorami wiązania wodorowego. Zasadowość amin rośnie, gdy zwiększana jest gęstość elektronowa na atomie azotu.
W zależności od ilości atomów wodoru związanych z atomem azotu rozróżniamy aminy pierwszo-, drugo-, trzeciorzędowe oraz czwartorzędowe sole amoniowe.
| 200px | 200px | 200px | 200px |
| amina 1o | amina 2o | amina 3o | 4o sól amoniowa |
Aminy naturalne to m.in. alkaloidy (występują w roślinach, posiadają właściwości zasadowe, często silnie wpływają na układ nerwowy człowieka).
Przykłady znanych amin
- Atropina — jest toksycznym alkaloidem pozyskiwanym z roślin z rodziny psiankowatych, np. z pokrzyku wilczej jagody (Atropa beladonna).
- Nikotyna — alkaloid zawarty w liściach tytoniu. W dużych dawkach toksyczny, w małych pobudzający. Wywołuje uzależnienie.
- Serotonina — biologicznie czynna amina, hormon pełniący funkcję m.in. ważnego neuroprzekaźnika w ośrodkowym układzie nerwowym.

|

|

|
| Atropina | Nikotyna | Serotonina |
AMIDY
Amidami nazywane są pochodne kwasów, w których grupa hydroksylowa zastąpiona została grupą "-NR2", przy czym R może być atomem wodoru, alkilem lub arylem.

|

|

|
| acetamid | N-alkilo(arylo)acetamid | N,N-dialkilo(arylo)acetamid |
| amid niepodstawiony (1o) | amid monopodstawiony (2o) | amid dipodstawiony (3o) |
Atom węgla grupy amidowej, podobnie jak we wszystkich innych związkach zawierających funkcję karbonylową, ma hybrydyzację sp2. Wolna para elektronów atomu azotu jest sprzężona z elektronami [math]\pi[/math] grupy karbonylowej i przez to atom ten nie tylko traci właściwości zasadowe (powinowactwo do protonu) ale również wiązanie C-N częściowo nabiera charakteru wiązania podwójnego.
Dlatego też amidy są bardzo mało reaktywne (również trudno hydrolizują).
Występowanie
Amidy w postaci peptydów i białek są bardzo rozpowszechnione w przyrodzie. Są to związki, w których wiązanie amidowe, zwane wiązaniem peptydowym utworzone jest pomiędzy grupą aminową jednego aminokwasu i grupą karboksylową drugiego aminokwasu.
Wiele włókien syntetycznych także ma budowę poliamidową:
- Nylon-6,6 — poliamid otrzymany w wyniku polikondensacji kwasu adypinowego i 1,6-heksylodiaminy, wykorzystywany m.in. do produkcji rajstop.
- Kevlar — poliamid bogaty w układy aromatyczne. Z tego materiału produkowane są włókna stosowane m.in. w kamizelkach kuloodpornych.

|
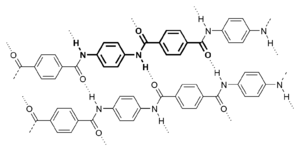
|
| Synteza nylonu | Kevlar |
AMINOKWASY
Aminokwasami nazywamy związki zawierające w swej cząsteczce dwie charakterystyczne grupy funkcyjne: aminową — NH2 i karboksylową — COOH.
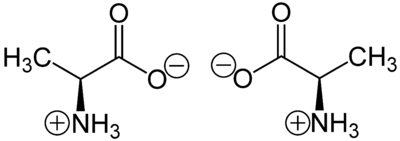
Najprostszym aminokwasem jest glicyna (kwas 2-aminoetanowy; Gly). Glicyna, jako jedyny aminokwas, jest achiralna (posiada płaszczyznę symetrii).
Alanina (kwas 2-aminopropanowy; Ala) posiada dwa enancjomery (o konfiguracji absolutnej S i R).
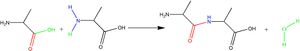
Wszystkie naturalnie występujące aminokwasy (poza cysteiną) posiadają konfigurację absolutną S. Aminokwasy są najmniejszymi elementami strukturalnymi białek, polipeptydów i peptydów. Najważniejszą reakcją aminokwasów, z punktu widzenia biochemicznego, jest reakcja tworzenia wiązania peptydowego (amidowego).
W wyniku kondensacji dwóch cząsteczek alaniny, tworzy się dwupeptyd i wydziela woda.
W reakcji bierze udział C-koniec jednej cząsteczki aminokwasu i N-koniec drugiej.
Oczywiście aminokwasy mogą kondensować w dowolnej kolejności. Mogą też tworzyć się struktury cykliczne.
Powstające wiązanie peptydowe jest planarne (płaskie). Dzięki stabilizacji rezonansowej ma częściowo charakter wiązania podwójnego, zatem zahamowana jest swobodna rotacja wokół wiązania C-N.
Istnieje 20 podstawowych aminokwasów budujących białka (tabela i jej legenda pochodzi z polskiej wikipedii).
| Skrót | Pełna nazwa | Typ aminokwasu | Masa cz.(**) | Punkt izoel | Wzór strukturalny | Uwagi | |
|---|---|---|---|---|---|---|---|
| A | Ala | Alanina | obojętny hydrofobowy alifatyczny | 71,0788 | 6,11 | 
|
|
| C | Cys | Cysteina | obojętny hydrofobowy aminokwas siarkowy | 103,1388 | 5,05 | 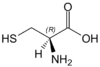
|
Dwie cysteiny mogą utworzyć mostek dwusiarczkowy tworząc tzw. cystynę |
| D | Asp | Kwas asparaginowy | kwaśny | 115,0886 | 2,85 | 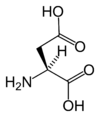
|
|
| E | Glu | Kwas glutaminowy | kwaśny | 129,1155 | 3,15 | ||
| F | Phe | Fenyloalanina (*) | obojętny hydrofobowy aromatyczny | 147,1766 | 5,49 | 
|
|
| G | Gly | Glicyna | obojętny hydrofobowy | 57,0519 | 6,06 | 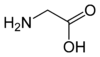
|
Ponieważ przy węglu α znajdują się dwa atomy wodoru, glicyna nie jest optycznie czynna. |
| H | His | Histydyna (*) | zasadowy | 137,1411 | 7,60 | 
|
|
| I | Ile | Izoleucyna (*) | obojętny hydrofobowy alifatyczny | 113,1594 | 6,05 | 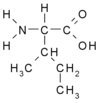
|
|
| K | Lys | Lizyna (*) | zasadowy | 128,1741 | 9,60 | 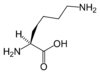
|
|
| L | Leu | Leucyna (*) | obojętny hydrofobowy alifatyczny | 113,1594 | 6,01 | 
|
|
| M | Met | Metionina (*) | obojętny hydrofobowy | 131,1926 | 5,74 | zawiera siarkę | |
| N | Asn | Asparagina (Amid kwasu asparaginowego) |
hydrofilowy | 114,1038 | 5,41 | 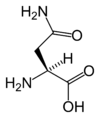
|
|
| P | Pro | Prolina | hydrofobowy heterocykliczny | 97,1167 | 6,30 | 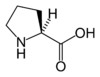
|
Może zakłócać takie struktury białka jak helisa alfa i harmonijka beta. Od innych aminokwasów odróżnia się brakiem pierwszorzędowej grupy aminowej. |
| Q | Gln | Glutamina (Amid kwasu glutaminowego) |
hydrofilowy | 128,1307 | 5,65 | ||
| R | Arg | Arginina | zasadowy | 156,1875 | 10,76 | 
|
|
| S | Ser | Seryna | obojętny hydrofilowy hydroksyaminokwas | 87,0782 | 5,68 | 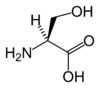
|
|
| T | Thr | Treonina (*) | obojętny hydrofilowy hydroksyaminokwas | 101,1051 | 5,60 | 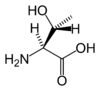
|
|
| V | Val | Walina (*) | obojętny hydrofobowy alifatyczny | 99,1326 | 6,00 | 
|
|
| W | Trp | Tryptofan (*) | obojętny hydrofobowy aromatyczny i heterocykliczny | 186,2132 | 5,89 | 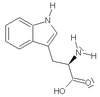
|
|
| Y | Tyr | Tyrozyna | obojętny słabo hydrofobowy | 163,1760 | 5,64 | 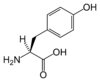
|
|
Legenda
- (*) aminokwasy egzogenne; pozostałe to aminokwasy endogenne
- (**) w środowisku wodnym do masy aminokwasu należy doliczyć masę 1 cz. wody
Podane wyżej aminokwasy nie są wszystkimi występującymi w białkach. Aminokwasy białkowe o innej budowie powstają zazwyczaj w wyniku modyfikacji potranslacyjnych (np. hydroksyprolina). Wyjątkowym przykładem jest selenocysteina, która ulega kotranslacyjnemu wbudowaniu w powstające białko, jest więc niekanonicznym aminokwasem, który nie powstaje poprzez modyfikacje potranslacyjne.
Ze względu na zapotrzebowanie aminokwasów przez organizm zwierzęcy można je podzielić na:
- Aminokwasy egzogenne — niezbędne do prawidłowego funkcjonowania organizmu zwierzęcego, ale nie wytwarzane przez ten organizm. Muszą być dostarczane z zewnątrz wraz z pokarmem. Dla organizmu człowieka są to m. in.: walina, leucyna, izoleucyna, lizyna, fenyloalanina, metionina, treonina, tryptofan, arginina i histydyna.
- Aminokwasy endogenne — niezbędne do prawidłowego funkcjonowania organizmu i wytwarzane przez ten organizm. Dla organizmu człowieka są to: glicyna, alanina, seryna, cysteina, tyrozyna, kwas asparaginowy, kwas glutaminowy, hydroksyprolina, asparagina, glutamina, prolina.
BIAŁKA
Białka zbudowane są z pojedynczego łańcucha lub kilku łańcuchów polipeptydowych. Masy cząsteczkowe białek mieszczą się w szerokich granicach od 10 000 Da (daltonów) do kilku milionów daltonów (1 Da=1/12 masy izotopu węgla 12C). W budowie białek wyróżnia się kilka poziomów organizacji ich struktury:
Struktura pierwszorzędowa
to liniowa sekwencja kolejnych aminokwasów połączonych wiązaniami peptydowymi w białkach (polipeptydach), bez uwzględnienia układu przestrzennego.
Struktura drugorzędowa
— opisuje konformacje łańcuchów (helikalną i pofałdowaną) powstałe w wyniku utworzenia wiązań wodorowych między grupami karbonylowymi i amidowymi głównego łańcucha polipeptydowego oraz mostków disulfidowych. Wyróżniamy tu tzw. α–helisę i β–harmonijkę.
Struktura trzeciorzędowa
określa trójwymiarowe pofałdowanie danego łańcucha polipeptydowego wywołane wewnątrzcząsteczkowym oddziaływaniem łańcuchów bocznych. Strukturę tę stabilizują wiązania wodorowe, mostki disulfidowe i siły van der Waalsa.
Struktura czwartorzędowa
— pojęcie to obejmuje występujące w wielu białkach asocjacje monomerów białkowych o oddzielnej strukturze drugo- i trzeciorzędowej w kompleksy oligomeryczne. Asocjacja i agregacja zachodzi w wyniku oddziaływań między polarnymi, zjonizowanymi i niepolarnymi łańcuchami bocznymi aminokwasów, a są to oddziaływania:
- dyspersyjne,
- hydrofobowe,
- jonowe,
- wodorowe,
- czasem stabilizacja następuje dzięki mostkom disulfidowym.
Przykładem białek o poznanej strukturze czwartorzędowej jest
hemoglobina.
Biologicznie ważne peptydy
Glutation
(tripeptyd H-γ-Glu-Cys-Gly-OH) — odgrywa zasadniczą rolę w procesach utleniania i redukcji dzięki obecności grup –SH).
Angiotensyna II
(oktapeptyd H-Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-OH) — hormon tkankowy, zwęża naczynia krwionośne i jest najsilniejszym czynnikiem podwyższającym ciśnienie krwi.
Bradykinina
(nonapeptyd H-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg-OH) — hormon tkankowy, obniża ciśnienie krwi—zatem działa antagonistycznie do angiotensyny, odpowiedzialna jest również za uczucie bólu, który towarzyszy uszkodzeniu (zranieniu) skóry).
Hemoglobina
— czerwony barwnik krwi, białko zawarte w erytrocytach, którego zasadniczą funkcją jest przenoszenie tlenu — przyłączanie go w płucach i uwalnianie w tkankach, jest tetramerem, a każda z jednostek zawiera grupę prostetyczną hem.
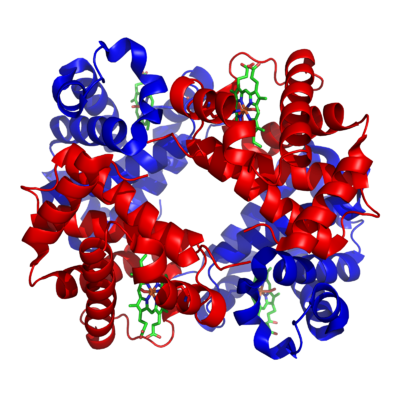
|
400px |
| Model cząsteczki hemoglobiny | Struktura hemu |
Funkcja biologiczna białek
Ze względu na funkcje biologiczne białka dzielimy na:
- Enzymy
- Białka zapasowe
- Białka regulatorowe
- Białka strukturalne
- Białka ochronne
- Białka transportujące
Enzymy
Enzymy (biokatalizatory), przyspieszają reakcje chemiczne niekiedy aż do 1012 razy! Enzymy nie zmieniają wzajemnej proporcji energii substratów i produktów, obniżają tylko energię aktywacji, często zmieniając przebieg (mechanizm) reakcji.
Mechanizm działania enzymu
można opisać za pomocą modelu indukowanego dopasowania.
Jest to zmodyfikowany model „klucza i zamka”, który wyjaśniał jedynie specyficzność działania enzymu, ale nie brał pod uwagę dynamicznych zmian kształtu cząsteczki biokatalizatora i wpływu tego zjawiska na przebieg procesu transformacji kompleksu enzymsubstrat w kompleks enzym-produkt.
Kinetyka działania enzymu
Szybkość reakcji katalizowanych przez enzymy zależy od wielu czynników. Są to m.in. temperatura, pH, a także stężenie substratów. Rozważmy ten ostatni czynnik.

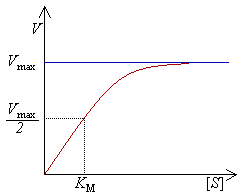
Reakcja katalizowana przez enzymy jest dwuetapowa. W pierwszym etapie substraty wiążą się odwracalnie z enzymem, tworząc ze stałą szybkości k1, kompleks enzym-substrat (ES). W następnym etapie, kompleks ten może się rozpaść na dwa różne sposoby. Może dysocjować na powrót do E i S ze stałą szybkości k1 lub może dojść do chemicznej zmiany substratów i uwolnienia produktów ze stałą szybkości k2, przy czym zakłada się, że produkt reakcji nie może ulec powrotnemu przekształceniu w wyjściowy substrat. Wyrażenie wiążące szybkość katalizy ze stężeniem substratu i enzymu oraz z szybkościami poszczególnych etapów opisane jest równaniem Michaelisa-Menten:
[math] V_0=V_{\max}\frac{[S]}{[S]+K_m} [/math]
gdzie: [math]V_0[/math] — szybkość początkowa, [math]S[/math] — stężenie substratu, [math]K_m[/math] — stała Michaelisa-Menten.
| Krzywa zawartości enzymu w roztworze przedstawiająca związek
pomiędzy stężeniem substratu i szybkości reakcji. |
Krzywa wysycenia dla reakcji enzymatycznej ukazująca zależność
szybkości reakcji ([math]V[/math]) od stężenia substratu ([math][S][/math]). |
Od pewnej wartości stężenia substratu praktycznie nie można zwiększyć szybkości reakcji.
KWASY NUKLEINOWE
Komponenty wchodzące w skład kwasów nukleinowych, to :
Nukleozydy
to glikozoaminy powstałe w wyniku połączenia zasady azotowej (pirymidynowej lub purynowej) z rybozą lub deoksyrybozą poprzez wiązanie β-N-glikozydowe.

|

|

|
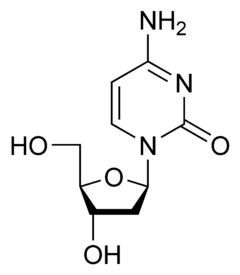
|
| Adenozyna | Guanozyna | Tymidyna | Deoksycytydyna |
| A | G | T | dC |
Nukleotydy
zbudowane są z reszty cukrowej — pentozy (w DNA jest to deoksyryboza, zaś w RNA — ryboza), co najmniej jednej reszty fosforanowej i zasady azotowej: purynowej lub pirymidynowej.

|

|
| AMP – Adenozynomonofosforan | GTP – guanozynotrifosforan |
Kwasy nukleinowe
to biopolimery zbudowane z nukleotydów połączonych wiązaniami 3'-5' diestrowymi. W naturze występują dwa typy kwasów nukleinowych DNA i RNA oraz kilka syntetycznych analogów kwasów nukleinowych.
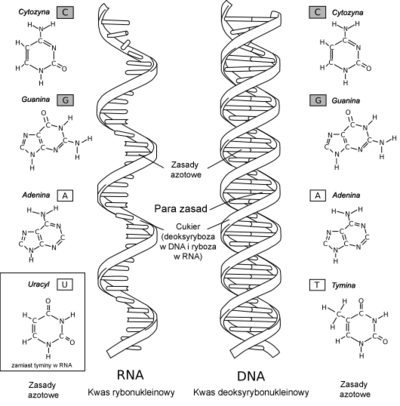
Kwas deoksyrybonukleinowy
— DNA — występuje w chromosomach i pełni rolę nośnika informacji genetycznej organizmów żywych. W skład cząsteczki DNA zwykle wchodzą dwa łańcuchy, które biegną antyrównolegle (tzn. koniec jednego jest dokładnie naprzeciw początku drugiego). Łańcuchy owijają się wokół wspólnej osi i tworzą tzw. prawoskrętną podwójną helisę. Reszty cukrowe i fosforowe, połączone ze sobą wiązaniem fosfodiestrowym, znajdują się na zewnątrz helisy, natomiast zasady skierowane są do wnętrza i tworzą pary zasad połączone według wzoru: A-T, C-G.
Kwasy rybonukleinowe
— RNA — w komórce występuje wiele klas kwasów rybonukleinowych różniących się pełnioną funkcją, a także masą cząsteczkową i strukturą, m.in.: rybosomowe (rRNA), informacyjne zwane matrycowymi (mRNA).