Chemia organiczna/Alkiny
Budowa i nazewnictwo alkinów
Alkiny zawierają potrójne wiązanie węgiel-węgiel. Wzór ogólny: [math]\mathrm C_n\mathrm H_{2n-2}[/math]. Są więc izomerami dienów, cykloalkenów, ewentualnie cykloalkanów dwupierścieniowych. Właściwości fizyczne mają podobne do odpowiednich alkanów i alkenów (pierwsze człony szeregu homologicznego — gazy, do ok. 18 atomów węgla w cząsteczce — ciecze). Hybrydyzacja atomów węgla związanych potrójnie jest typu sp. Budowa fragmentu —C≡C— jest liniowa. Długość wiązania C≡C wynosi ok. 0,120 nm.
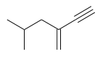
Nazwy alkinów wywodzą się z nazw macierzystych alkanów z końcówką -in (po spółgłoskach ch, f, g, k, l) lub -yn (po pozostałych spółgłoskach) zamiast -an. Zasady nazewnictwa systematycznego alkinów są zgodne z ogólnymi regułami nazywania węglowodorów. Pamiętać jednakże należy, że w nazewnictwie wiązanie podwójne ma pierwszeństwo przed wiązaniem potrójnym a łańcuch główny powinien zawierać, o ile to możliwe, wszystkie wiązania wielokrotne i może się zdarzyć, że łańcuch główny nie jest najdłuższy w cząsteczce. Adekwatne przykłady podane są ponizej na Rys. Figure 1.
| etyn | |
| propyn | |
| but-2-yn | |
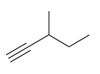
|
3-metylopent-1-yn |
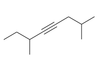
|
2,6-dimetylookt-4-yn |
| heks-1-en-5-in | |
|
2-izobutylobut-1-en-3-in |
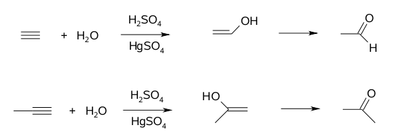
Reakcjami charakterystycznymi alkinów są reakcje addycji (przyłączania) do wiązania wielokrotnego z rozerwaniem jednego, albo obu wiązań [math]\pi[/math]. Podobnie jak dla alkenów mogą to być reakcje przyłączania wodoru (wodorowanie katalityczne), przyłączanie chlorowców (chloru, bromu), przyłączanie chlorowcowodorów (HCl, HBr, HI), itp. Rys. Figure 2. obrazuje przyłączanie wody do alkinów. Pierwotnymi produktami tych reakcji są alkohole z grupą —OH przy węglu z podwójnym wiązaniem (enole), które jednak nie są trwałe i przegrupowują się do związków karbonylowych (aldehydów i ketonów). Tego typu przegrupowanie, podczas którego swoje położenie zmienia atom wodoru w cząsteczce (jednocześnie z przeniesieniem w przeciwnym kierunku pary elektronowej [math]\pi[/math] z jednego wiązania na inne) nazywamy tautomerią, a obiekty wykazujące to zjawisko — tautomerami. Wiele innych przypadków tautomerii poznamy w późniejszym toku wykładu.
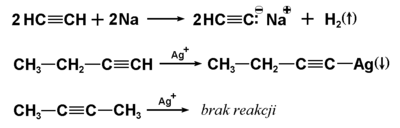
Cechą odróżniającą alkiny od alkenów i alkanów jest dużo większa kwasowość atomu wodoru związanego z atomem węgla przy potrójnym wiązaniu. Oczywiście mowa tu o kwasowości względnej. W porównaniu na przykład z wodą alkiny okazują się słabszymi kwasami. Reakcje świadczące o kwasowych właściwościach alkinów zawierających wodór przy potrójnym wiązaniu są podane na Rys. Figure 3.
Strzałki obok produktów reakcji oznaczają w pierwszym przypadku wydzielanie się gazu, a w drugim — wytrącanie się osadu.
Actylen
Najważniejszym przedstawicielem alkinów jest etyn, nazywany powszechnie acetylenem. Znajduje on duże zastosowanie w przemyśle chemicznym do otrzymywania wielu związków, a przede wszystkim półproduktów do syntezy polimerów. Wykorzystywany też jest w palnikach acetylenowo-tlenowych do uzyskiwania wysokich temperatur niezbędnych przy spawaniu metali. Dawniej był stosowany w przenośnych lampach, tzw. karbidówkach, w których był otrzymywany na bieżąco z karbidu (węglik wapnia, CaC2) pod działaniem wody. Poniższy Rys. Figure 4. podaje metodę uzyskiwania acetylenu z łatwo dostępnych surowców.
Grupy alkenylowe i alkinylowe.
Podobnie jak w przypadku alkanów, reszty węglowodorów nienasyconych po formalnym oderwaniu atomu wodoru noszą swoje określone nazwy, dopuszczone do stosowania w nazewnictwie systematycznym. Zastosowanie ich ogranicza się oczywiście do tych przypadków, gdy obecność wiązania wielokrotnego nie może być zaznaczona w przyrostku nazwy. Rys. Figure 5. podaje wzory i nazwy prostych podstawników (grup) wywodzących się z alkenów i alkinów.
| Budowa | Nazwa | Budowa | Nazwa |
|---|---|---|---|
| CH2=CH— | winyl | CH2=CH—CH2— | allil |
| CH3—CH=CH— | propenyl | HC≡C— | etynyl |
| HC≡C—CH2— | propargil | CH3—C≡C— | propynyl |